El fascinante átomo de carbono
La vida en nuestro planeta es posible gracias a dos fenómenos que constituyen una rareza en el mundo de la química: el enlace de hidrógeno (erróneamente llamado puente de hidrógeno) y la catenación del carbono.
En el caso de la molécula de agua, H2O, el enlace de hidrógeno es una fuerza de atracción que ocurre entre el hidrógeno de una molécula, y el oxígeno de otra molécula. Esta atracción se debe a que el hidrógeno es electropositivo, y el oxígeno es electronegativo. Sin el enlace de hidrógeno, el agua no podría existir en estado líquido o sólido a la temperatura ambiental de la Tierra. Sería un gas, al igual que todos los compuestos cuyas moléculas tienen una masa molar tan baja como la del agua.
Por otro lado, la catenación es la capacidad de un elemento para formar cadenas; es decir, para unirse químicamente consigo mismo. El carbono no es el único elemento que tiene esta capacidad, pero es el que más tiende a hacerlo, y en las formas más variadas.
EL ÁTOMO DE CARBONO
El símbolo del átomo de carbono es “C”. En español, “carbono” y “carbón” no significan lo mismo: “carbono” es el elemento químico, mientras que “carbón” es un sólido compuesto principalmente por átomos de carbono. El carbono que se encuentra en la Tierra no se formó dentro de nuestro sistema solar, sino en generaciones anteriores de estrellas, hace más de 5,000 millones de años, mediante reacciones de fusión nuclear en su interior. Cuando esas estrellas agotaron su combustible, expulsaron el carbono al espacio, y ese material formó parte de la nube de gas y polvo que, al colapsar, dio origen al Sol y a los planetas. Aunque el carbono representa solo alrededor del 0.025 % en masa de la corteza terrestre (y cerca de 0.002 % del planeta completo), es un elemento esencial para la vida y los procesos geoquímicos. En abundancia global dentro de la Tierra, ocupa aproximadamente el decimoquinto lugar entre los elementos químicos.
El carbono pertenece al grupo 14 de la tabla periódica, cuyos elementos son: carbono (C), silicio (Si), germanio (Ge), estaño (Sb) y plomo (Pb). Los primeros tres son no metales, y los últimos dos son metales. Todos estos elementos comparten la capacidad de catenación, pero ninguno de ellos lo hace con tanta facilidad como el carbono.
Además de concatenarse, el carbono puede hacerlo mediante enlazamiento múltiple, lo que significa enlazarse entre sí mediante enlaces dobles y triples. Esta última propiedad es común al nitrógeno y al oxígeno, pero en dichos casos, la catenación es relativamente poco frecuente.
Los átomos de carbono pueden unirse entre sí en una variedad de formas y en una cantidad de átomos, imposible para cualquier otro elemento. Pueden formar cadenas de miles de átomos o anillos de todos los tamaños; estas cadenas y anillos pueden tener ramificaciones. A los carbonos de estas cadenas y anillos se unen otros átomos; principalmente hidrógeno, oxígeno, flúor, cloro, bromo, yodo, nitrógeno, azufre, fósforo…
Esta particular característica es la que permite que existan tantos compuestos de carbono. El número de compuestos que contienen carbono es varias veces mayor que el número de sustancias que no lo contienen.
EL SURGIMIENTO DE LA VIDA Y EL PROCESO DE CONVERSIÓN DEL CO2 EN MOLÉCULAS ORGÁNICAS A TRAVÉS DE LA FOTOSÍNTESIS.

Durante la formación de la Tierra, su atmósfera se componía principalmente de vapor de agua, dióxido de carbono y nitrógeno, junto con otros gases emitidos por la acción volcánica. La vida inició con los vegetales hace unos 3000 millones de años, en las aguas tibias de los océanos y los mares, y originalmente en formas de plantas primitivas. Esta forma de vida evolucionó debido a su habilidad para fotosintetizar, tomando como materia prima el dióxido de carbono de la atmósfera, y reemplazándolo por oxígeno. En el proceso de fotosíntesis, la planta convierte el CO2 en las cadenas de celulosa y demás moléculas que la conforman, y que, como veremos adelante, los químicos han denominado moléculas orgánicas.
Las primeras formas de plantas y algas crecieron en una abundancia masiva a lo largo de millones de años. Las formas de vida animal evolucionaron mucho después, probablemente hace alrededor de 2000 millones de años, y fueron totalmente dependientes del oxígeno generado por la flora de ese tiempo.
Los animales herbívoros se alimentan de plantas, y los animales carnívoros se alimentan de otros animales. Por lo tanto, todos los seres vivos, plantas y animales, partimos del CO2 como materia prima para formar nuestros tejidos. Podemos estar conscientes, entonces, de que todos nuestros tejidos fueron CO2.
El principal compuesto presente en el cuerpo humano es el agua, pero en segundo lugar están las moléculas orgánicas a base de cadenas de carbono. Por lo tanto, el oxígeno representa la mayor parte de la masa del cuerpo humano (65%), y en segundo lugar está el carbono (18%). El 99 % de la masa del cuerpo humano está formada por seis elementos: oxígeno, carbono, hidrógeno, nitrógeno, calcio, y fósforo. El contenido de los elementos aluminio y silicio, aunque son muy abundantes en la Tierra, es muy bajo en el cuerpo humano.
LA QUÍMICA ORGÁNICA, O QUÍMICA [DE LAS CADENAS] DE CARBONO
Originalmente, los compuestos químicos se dividieron en dos grupos: inorgánicos y orgánicos, según de dónde provenían. Los compuestos inorgánicos eran aquellos que provenían de los minerales, y los orgánicos, los que se obtenían de fuentes vegetales y animales, o sea: de materiales producidos por organismos vivos. Hasta más o menos 1850, muchos químicos creían que los compuestos orgánicos debían tener su origen en organismos vivos y, en consecuencia, jamás podrían ser sintetizados a partir de sustancias inorgánicas.
Todos los compuestos de fuentes orgánicas contenían el elemento carbono. Aún después de que quedó establecido que estos compuestos no necesariamente debían provenir de fuentes vivas, ya que podían sintetizarse en el laboratorio, resultó conveniente mantener el nombre orgánico para describirlos, y es así que hasta la fecha, los compuestos se clasifican en inorgánicos y orgánicos.
Los compuestos orgánicos se han agrupado en familias que, en general, no tienen equivalentes entre los inorgánicos.
La química orgánica ha desarrollado métodos para descomponer moléculas complicadas para reordenar los átomos y generar moléculas nuevas, para agregar átomos a las moléculas existentes o para sustituir átomos nuevos por antiguos. Su objetivo es sintetizar nuevas moléculas que proporcionen soluciones o mejoras a las actividades humanas. La Chemical Abstracts Service (CAS) tiene registradas varias decenas de millones de moléculas, y cada día se registran más.
LA FORMACIÓN DE LOS YACIMIENTOS DE PETRÓLEO Y DE LAS MINAS DE CARBÓN
El petróleo y el gas natural son compuestos orgánicos que se formaron a partir de la materia orgánica acumulada en sedimentos del pasado geológico, y en asociación con materia inorgánica de los mares a lo largo de millones de años.
Por otro lado, hace alrededor de 500 millones de años, la flora había evolucionado considerablemente, y pasó de las aguas tibias de los mares, a la tierra. Al entrar en la era carbonífera, ocurrió un crecimiento masivo en la forma de selvas tropicales. En este tiempo, también los continentes se dirigían lentamente hacia el norte, a través de los climas más cálidos de las regiones ecuatoriales, con sus tormentas torrenciales. El desplazamiento continental con las depresiones y levantamientos correspondientes de la corteza terrestre, provocaron que áreas crecientes de estas selvas tropicales, lentamente y a través de millones de años, quedaran sumergidas en estuarios de ríos y en el mar. No todos los árboles de las selvas que crecieron a lo largo de un periodo de alrededor de 300 millones de años formaron minas de carbón. Probablemente solo uno de cada mil billones (1 x 1015) de árboles terminó en una mina de carbón. El resto, simplemente se descompuso en compuestos gaseosos y minerales.
Una importante etapa en la formación de carbón, a partir del material de estas selvas tropicales, fue el pantano, con su materia botánica descompuesta por bacterias aeróbicas y anaeróbicas, para crear el material residual que se convirtió en carbones, bajo subsecuentes influencias de tiempo, temperatura y presión, asociadas al entierro de material, normalmente a distancias profundas.
Este proceso de carbonización continuó debajo de la tierra, mientras que los continentes se movían hacia el norte hasta la posición en la que se encuentran actualmente. Las propiedades de los carbones de las distintas zonas carboníferas del mundo no son idénticas, incluyendo los carbones que se encuentran a diferentes niveles dentro de una misma beta. Algunos carbones se formaron mucho tiempo después de que había terminado la era carbonífera; es decir, en el periodo cretáceo, asociado con los dinosaurios.
Los carbones más viejos o más maduros son las antracitas, y que esencialmente no se funden al calentar. Los carbones de hulla (o bituminosos), de edad intermedia, se funden al calentar. Estos carbones son los que se utilizan para fabricar coque metalúrgico para las industrias de producción de fierro y acero. Los carbones más jóvenes son los lignitos y los carbones marrones, que son relativamente ricos en oxígeno e hidrógeno.
Por lo tanto, las materias primas de la industria del carbón se asocian claramente con los minerales fósiles del mundo. Debido al extenso rango de condiciones geológicas que existieron en la formación, tanto de petróleo como de carbón, se entiende que estos materiales exhiben considerable variación en sus propiedades físicas y químicas. Dichas diferencias llevan a distintos usos de estos materiales, particularmente en las industrias de producción de fierro y aluminio.
LOS ISÓTOPOS DEL CARBONO, Y EL CARBONO-14 COMO MÉTODO PARA MEDIR LA EDAD DE RESTOS DE ORIGEN ORGÁNICO
Lo que define a cada elemento es el número atómico, que corresponde al número de protones contenidos en su núcleo. El número atómico del carbono es 6. Pero cada elemento puede tener distinto número de neutrones. Se denominan isótopos a los átomos de un mismo elemento, cuyo núcleo tiene una cantidad deferente de neutrones. Esto hace que los isótopos difieran en su masa atómica.
El carbono natural tiene tres isótopos. El más común es el carbono-12 o 12C, que representa el 98.89 % de todo el carbono que existe en la Tierra. Su núcleo está formado por 6 protones y 6 neutrones. El carbono-13 (13C) también es estable, representa el 1.11% del carbono presente en la Tierra, y su núcleo contiene 6 protones y 7 neutrones. Y el carbono-14 (14C) es un isótopo radiactivo del carbono, presente en una pequeñísima cantidad. Su núcleo contiene 6 protones y 8 neutrones.
La vida media del 14C es de 5730 años. Vida media es el tiempo que tarda la concentración de un elemento o compuesto que se descompone —como es el caso de los radiactivos— en disminuir a la mitad. El 14C se está formando constantemente, a consecuencia de reacciones que ocurren entre los neutrones de los rayos cósmicos y los átomos de nitrógeno de las capas altas de la atmósfera. El neutrón sustituye a uno de los protones de un átomo de nitrógeno, y lo convierte en un átomo de 14C.
De esta manera, la producción de carbono-14 es constante y está presente en la atmósfera en pequeñísimas cantidades. Los átomos de 14C reaccionan con el oxígeno gaseoso para formar moléculas radiactivas de dióxido de carbono, las cuales son absorbidas por las plantas en la fotosíntesis. Las criaturas que comen plantas y las criaturas que se alimentan de las criaturas que comen las plantas contienen todas ellas la misma proporción de 14C radiactivo. Cuando el organismo muere, la ingestión de carbono cesa, y el que ya está presente en el organismo se desintegra. Por tanto, se puede determinar la edad de un objeto midiendo la cantidad de 14C presente en una muestra del mismo. Este método ofrece una escala absoluta para fechar objetos de entre 1,000 y 20,000 años de antigüedad. W. F. Libby se hizo acreedor al premio Nobel de química en 1960 por el desarrollo de la técnica de fechado con radiocarbono.
LOS ALÓTROPOS DE CARBONO
La alotropía es la propiedad que poseen algunos elementos de existir en formas estructurales distintas en un mismo estado físico. Estas formas se denominan alótropos.
Durante siglos se conocieron dos alótropos comunes del carbono: el diamante y el grafito. Ambos son sólidos cristalinos, formados exclusivamente por átomos de carbono unidos mediante enlaces covalentes. Sin embargo, difieren completamente en la forma en que esos átomos se enlazan. En tiempos recientes se ha descubierto toda una familia de nuevas estructuras, como los fulerenos, los nanotubos de carbono y el grafeno.
Diamante
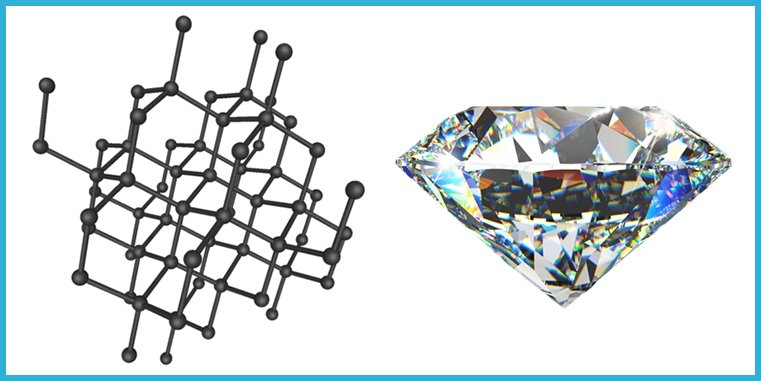
El diamante posee una estructura tridimensional muy ordenada, en la que cada átomo de carbono está unido a otros cuatro. Esta red rígida explica que sea el material natural más duro y rígido que se conoce. Su estructura estable impide el desplazamiento de electrones, por lo que es aislante eléctrico. Sin embargo, la fuerte unión entre sus átomos le confiere una conductividad térmica extraordinaria, unas cinco veces superior a la del cobre. Su densidad es de 3.5 g/cm³.
Grafito

El grafito, en cambio, está formado por capas planas de átomos de carbono organizadas en forma de hexágonos, como un panal de abejas. Cada capa puede deslizarse fácilmente sobre otra porque están unidas por fuerzas muy débiles. Esa característica le da sus propiedades lubricantes. Dentro de cada capa hay electrones que se mueven libremente, lo que le permite conducir la electricidad.
El grafito se utiliza como lubricante, material conductor y en la fabricación de lápices de mina, donde se mezcla con arcilla: cuanta más arcilla contiene, más duro es el trazo. La mezcla común se denomina HB; las más duras, H, y las más suaves, B.
 Placa de grafeno
Placa de grafeno
El grafito puede transformarse en diamante bajo condiciones de alta presión y temperatura, del orden de 5 GPa (≈50,000 atm) y 1,600 °C. Este proceso se aplica industrialmente para producir diamantes sintéticos, que no poseen las características ópticas ni estéticas adecuadas para su uso como gemas, pero sí una gran utilidad en herramientas de corte y perforación para materiales muy duros.
El descubrimiento de una nueva familia de alótropos del carbono fue un hallazgo inesperado. Los fulerenos son estructuras en las que los átomos de carbono se organizan en formas esféricas o elipsoidales, constituidas por anillos de cinco y seis miembros en un patrón similar al de un balón de fútbol. El primero identificado fue el C₆₀, conocido como buckminsterfulereno o informalmente “futboleno”. Esta molécula, de 60 átomos de carbono, forma una esfera perfecta y es el fulereno más fácil de preparar. El C₇₀, el siguiente en abundancia, adopta una forma elipsoidal, semejante a un balón de rugby.

Esta familia recibe su nombre en honor a R. Buckminster Fuller, el visionario arquitecto e inventor del siglo XX, creador del domo geodésico, una estructura cuya disposición de triángulos reproduce el mismo patrón geométrico del C₆₀.
Además de las formas esféricas, los fulerenos pueden organizarse en tubos cilíndricos, conocidos como nanotubos de carbono, con propiedades mecánicas y electrónicas excepcionales. Se ha comprobado que los fulerenos naturales aparecen en el hollín, en depósitos de grafito e incluso en meteoritos y nubes interestelares, lo que sugiere que estas moléculas son comunes en el universo.

La química de los fulerenos y sus derivados continúa siendo un campo de intensa investigación, y hoy estas moléculas se encuentran disponibles comercialmente para aplicaciones en electrónica, catálisis y materiales avanzados.
Formas de carbón amorfo o semigrafítico

Un carbón amorfo es aquel en el que, a diferencia del grafito o del diamante, las cadenas o agrupamientos de átomos de carbono no presentan un arreglo cristalino ordenado. Un carbón semigrafítico es aquel en el que una parte de su estructura presenta regiones grafíticas, es decir, zonas donde los átomos de carbono están parcialmente ordenados en láminas semejantes a las del grafito.
Los usos principales del carbón son como fuente de energía y como agente reductor. Para estos fines se emplea una forma impura de carbón llamada coque, obtenida al calentar hulla en ausencia de aire. Durante este proceso, se destruye la estructura compleja de la hulla, se eliminan los compuestos volátiles (principalmente hidrocarburos) y queda como residuo un sólido poroso, de baja densidad, color plateado y brillo metálico. Los gases y vapores liberados constituyen un problema ambiental importante, ya que contienen compuestos carcinogénicos. El coque se utiliza principalmente en la producción de hierro.
El negro de humo es una forma finamente pulverizada de carbono, conocida también como micrografito, que se obtiene por la combustión incompleta de materiales orgánicos. Se producen entre 15 y 20 millones de toneladas al año y se mezcla con el caucho para aumentar la resistencia de los neumáticos y reducir su desgaste. Cada neumático promedio contiene aproximadamente 3 kg de negro de humo, responsable también de su color negro característico.
Otra forma es el carbón activado, un material con área superficial extremadamente alta (entre 500 y 3000 m²/g) que le confiere una gran capacidad de adsorción de compuestos no iónicos y de baja polaridad, como es el caso de la mayoría de las moléculas orgánicas.
Finalmente, los bloques de carbono tienen gran importancia industrial como electrodos en procesos electroquímicos y térmicos. Por ejemplo, cada año se consumen cerca de 7.5 millones de toneladas de carbono en la industria del aluminio. Y, por supuesto, el carbón vegetal sigue siendo un clásico del verano en los asadores domésticos.
Carbonatos y bicarbonatos
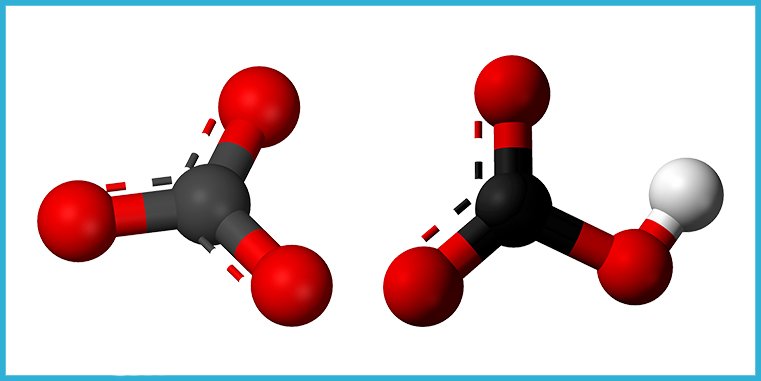
Carbonatos y bicarbonatos
El átomo de carbono también forma compuestos inorgánicos muy comunes en la corteza terrestre y en las aguas dulces y saladas, como los carbonatos (CO₃²⁻) y los bicarbonatos (HCO₃⁻). Los más frecuentes son los de sodio, calcio y magnesio. Estos compuestos, junto con los hidróxidos, determinan lo que se conoce como la alcalinidad del agua.
Los átomos de carbono pueden formar moléculas orgánicas en un momento y moléculas inorgánicas en otro. Al conjunto de transformaciones que experimenta este elemento se le llama ciclo del carbono.
Este texto no pretende describir exhaustivamente las características de todos los compuestos en los que participa el carbono. Algunos de ellos son de gran interés para el ser humano: el efecto invernadero del dióxido de carbono (CO₂) en la atmósfera terrestre; el biochar, beneficioso para el cultivo de muchas plantas; el monóxido de carbono (CO), altamente tóxico para los animales aeróbicos; y los carburos, entre otros.
Autor:
Germán Groso Cruzado
Bibliografía de contenidos del ciclo del carbono
Choppin, G. R., B. Jaffe, L. Summerlin y L. Jackson, QUÍMICA, Publicaciones Cultural, México, 1974. Ciclo del carbono.
Marsh, H., E. A. Heintz y F. Rodríguez-Reinoso (Eds.), INTRODUCTION TO CARBON TECHNOLOGIES, Publicaciones de la Universidad de Alicante, Alicante, 1997. Ciclo del carbono.
Morrison, R. T. y R. N Boyd, QUÍMICA ORGÁNICA, 3ª Ed., Fondo de Cultura Interamericano, México, 1976. Ciclo del carbono.
Rayner-Canham, G., QUÍMICA INORGÁNICA DESCRIPTIVA, 2ª Ed., Pearson Educación, México, 2000. Ciclo del carbono.
Artículos relacionados:
¿Qué es el carbón activado y para qué sirve?
¿Qué es el número de yodo del carbón activado?
Comparte:
Necesitas más información, escríbenos.
Algunos productos que te pueden interesar
-
Megapol 28-4 Carbón activado en polvo para decoloración de vinos, azúcar…
Leer más -
Megapol M – Carbón activado en polvo para decoloración
Cotizar -
AA-3 Carbón activado para reducir color y sabor en tequila y otros destilados
Cotizar -
AAM Carbón activado para eliminar color en tequila y otros destilados
Cotizar -
EBA-9 Carbón activado para tratamiento de tequilas y otros destilados
Cotizar -
IA-4 Carbón activado para tratamiento de tequilas y otros destilados
Cotizar -
Micro 10 Carbón activado de cáscara de coco
Cotizar -
Megapol C – Carbón activado en polvo de madera
Cotizar